在刚刚结束的由国际肺癌研究协会(IASLC)举办的世界肺癌大会(WCLC)上,第一三共携其领先DXd抗体偶联药物(ADC)产品组合亮相新加坡。本文特梳理精彩研究内容,带读者直击WCLC精彩现场。
2期临床研究HERTHENA-Lung01 结果显示,Patritumab Deruxtecan在EGFR突变的转移性非小细胞肺癌患者中显示出具有临床意义的持久疗效
Patritumab deruxtecan是一款采用第一三共独有的DXd ADC技术设计的潜在首个靶向HER3的抗体偶联药物(ADC)。
经盲法独立中心(BICR)评估,在225例EGFR突变的NSCLC患者中,patritumab deruxtecan(5.6 mg/kg)组患者确认的客观缓解率(ORR)为29.8%(95% CI:23.9~36.2)。其中1例完全缓解(CR),66例部分缓解(PR),99例疾病稳定。中位缓解持续时间(DOR)为6.4个月(95% CI:4.9~7.8),疾病控制率(DCR)为73.8%(95% CI:67.5~79.4)。截止至2023年05月18日数据截至日期,中位无进展生存期(PFS)为5.5个月(95% CI:5.1~5.9个月),中位总生存期为11.9个月(95% CI:11.2~13.1个月)。
各亚组的疗效结果一致,其中包括209名患者所在的既往接受过三代EGFR TKI和含铂化疗治疗亚组。Patritumab deruxtecan 针对不同的EGFR TKI耐药机制和不同的肿瘤HER3膜表达水平患者,均观察到抗肿瘤活性。
根据中枢神经系统(CNS)BICR评估显示,在30例基线有脑转移且既往未接受过放疗的患者亚组中观察到的颅内ORR为33.3%(95% CI:17.3~52.8%)。在这些患者中,有9例患者达到颅内完全缓解,1例达到颅内部分缓解,13例疾病稳定。观察到的CNS DOR为8.4个月(95% CI:5.8~9.2)。
截至2022年11月21日数据截止时,HERTHENA-Lung01临床研究中观察到patritumab deruxtecan的安全性特征与先前的临床试验一致。治疗中出现的不良事件(TEAE)导致终止治疗的比例较低(7.1%)。64.9%的患者出现了3级或3级以上的TEAE。最常见的(>5%)3级或3级以上TEAE包括血小板减少(21%)、中性粒细胞减少(19%)、贫血(14%)、白细胞减少(10%)、疲乏(6%)、低钾血症(5%)、乏力(5%)。经独立裁定委员会确定,12例患者(5.3%)出现确认的治疗相关间质性肺疾病(ILD)。大多数ILD事件级别较低,其中1例为1级事件,8例为2级事件。观察到两例3级事件和1例5级事件。
经盲法独立中心(BICR)评估,在HERTHENA-Lung01临床研究中,51%的患者(n=115)有中枢神经系统转移病史,其中32%患者(n=72)基线时有脑转移,33%患者(n=75)基线时有肝转移。63% (n=142)和36% (n=82)的患者分别在基线时检测到EGFR外显子19缺失或外显子21 L858R突变,其中一例患者两者都有。
在局部晚期/转移性疾病阶段,患者既往接受过的全身治疗线数中位值为3(范围为1~11),包括含铂化疗(100%)、三代EFGR TKI(93%)和免疫疗法(40%)。截至至2023年5月18日数据截止日期,中位持续时间为18.9个月(14.9~27.5),13例患者仍在接受patritumab deruxtecan治疗。
HERTHENA-Lung01数据结果总结
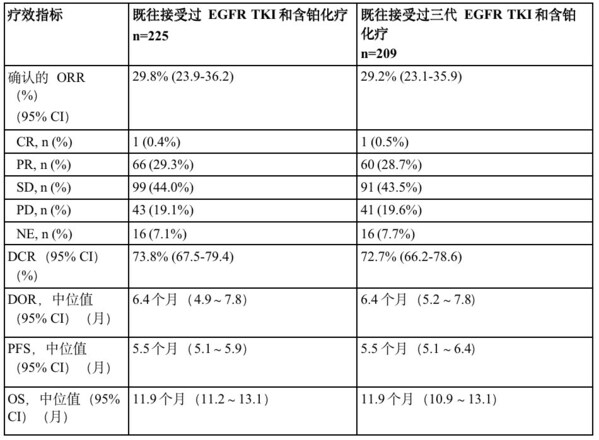
CR,完全缓解;DCR,疾病控制率;DOR,缓解持续时间;NA,无;NE,不可评估;ORR,客观缓解率;OS,总生存期;PR,部分缓解;PFS,无进展生存期;PD,疾病进展;SD,疾病稳定。
II期临床研究DESTINY-Lung02最新数据证实,优赫得®治疗既往经治HER2突变转移性非小细胞肺癌的患者获得了持久的肿瘤缓解
优赫得®是一款采用独有技术设计的HER2靶向抗体偶联药物(ADC),由第一三共和阿斯利康共同开发和商业化。
经盲法独立中心审查(BICR)评估结果显示,5.4 mg/kg治疗组和6.4 mg/kg治疗组的确认客观缓解率(ORR)分别为49.0%(95%置信区间[CI]:39.0~59.1)和56.0%(95% CI:41.3~70.0)。5.4 mg/kg治疗组中观察到1例(1.0%)完全缓解(CR)和49例(48.0%)部分缓解(PR),6.4 mg/kg治疗组中观察到2例(4.0%)全部缓解和26例患者(52.0%)部分缓解。5.4 mg/kg剂量组疾病控制率(DCR)达93.1% (86.4 ~ 97.2),6.4 mg/kg剂量组为92.0%(80.8 ~ 97.8)。5.4 mg/kg治疗组的中位缓解持续时间(DoR)为16.8个月(95% CI:6.4~不可估计[NE]),6.4 mg/kg治疗组未达到中位缓解持续时间(95% CI:8.3~NE)。
根据BICR评估,5.4 mg/kg组的中位PFS为9.9个月(95% CI:7.4~NE),6.4 mg/kg组为15.4个月(95% CI:8.3~NE)。5.4 mg/kg组的中位OS为19.5个月(95% CI:13.6~NE),6.4 mg/kg治疗组为未达到(95% CI:12.1~NE)。截止日期至2022年12月23日的数据,5.4 mg/kg治疗组(n=102)的中位随访时间为11.5个月,6.4 mg/kg治疗组(n=50)的中位随访时间为11.8个月。
在DESTINY-Lung02中,优赫得®5.4 mg/kg治疗组的患者安全性特征更佳,两种剂量均未发现新的安全信号。与5.4 mg/kg组相比,优赫得®6.4 mg/kg组的3级治疗中不良事件(TEAE)发生率更高。在优赫得®5.4 mg/kg组或6.4 mg/kg组治疗的所有患者中,分别有38.6%和58.0%患者出现了3级或3级以上的治疗相关TEAE。最常见的3级或3级以上治疗相关TEAE为中性粒细胞减少症(18.8% [5.4 mg/kg];36.0% [6.4 mg/kg])和贫血(10.9% [5.4 mg/kg];16.0% [6.4 mg/kg])。经独立裁定委员会确定,共报告了27例与治疗相关的间质性肺疾病(ILD)或非感染性肺炎病例(5.4 mg/kg治疗组发生率为12.9%;6.4 mg/kg治疗组发生率为28.0%)。在5.4mg/kg治疗组大多数事件级别较低(1级或2级事件为,10.9%,其中4例1级事件和7例2级事件),报告了1例3级事件、0例4级事件和1例5级事件。在6.4mg/kg治疗组中大多数事件级别较低(1级或2级事件为26%,其中4例1级事件9例2级事件),报告了0例3级事件、0例4级事件和1例5级事件。
DESTINY-Lung02主要分析结果
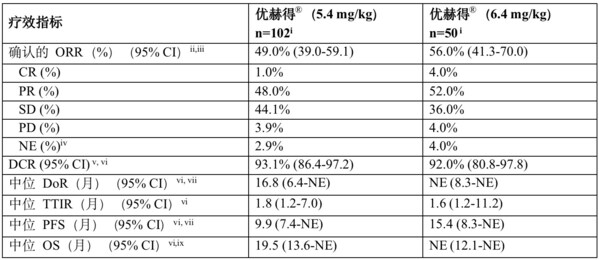
CI,置信区间;CR,完全缓解;DCR,疾病控制率;DoR,缓解持续时间;NE,不可估计;ORR,客观缓解率;OS,总生存期;PD,疾病进展;PFS,无进展生存期;PR,部分缓解;SD,疾病稳定;TTIR,至首次缓解时间
i. 数据截至日期: As of December 23, 2022
ii. 根据RECIST v1.1通过BICR评估确认的CR或PR的患者比例
iii. 客观缓解率= 完全缓解+部分缓解
iv. 5.4 mg/kg组三例患者为NE(一例患者因新冠肺炎(COVID)疫情而从未接受治疗;两例患者在首次肿瘤评估前终止治疗);6.4 mg/kg组一例患者为NE(在首次肿瘤评估前因不良事件而终止治疗)。
v. 疾病控制率=完全缓解+部分缓解+疾病稳定
vi. BICR评估
vii. 在5.4 mg/kg组和6.4 mg/kg组中,分别有60.0%和75.0%的患者被审查。
viii. 在5.4 mg/kg组和6.4 mg/kg组中,分别有56.9%和60.0%的患者被审查。
ix. 在5.4 mg/kg组和6.4 mg/kg组中,分别有63.7%和72.0%的患者被审查。
1b期临床研究TROPION-Lung04最新数据显示,datopotamab deruxtecan联合度伐利尤单抗用于一线治疗晚期肺癌患者具有良好的临床疗效
Dato-DXd是一款由第一三共和阿斯利康共同开发,采用独有DXd-ADC技术设计的TROP2靶向抗体偶联药物(ADC)。
在既往未接受过治疗的患者中, Dato-DXd联合度伐利尤单抗(n=14)的客观缓解率(ORR)为50.0%(95%置信区间[CI]:23.0-77.0,包括7例部分缓解(PR)),疾病控制率(DCR)为92.9%(95%置信区间[CI]:66.1-99.8)。接受Dato-DXd联合度伐利尤单抗和卡铂(n=13)治疗的患者中表现出更高的缓解率,ORR为76.9%(95% CI:46.2-95.0,包括10例PR),DCR为92.3%(95% CI:64.0-99.8)。无论PD-L1表达水平,均观察到缓解。
在既往接受过治疗和未接受过治疗的患者中,Dato-DXd联合度伐利尤单抗±卡铂的安全性特征与其他临床研究以及每种药物的已知安全性特征保持一致。在接受双联和三联治疗的患者中,3级或3级以上治疗中发生的不良事件(TEAE)发生率分别有42.1%和71.4%。接受三联治疗的患者中,最常见的3级或3级以上TEAE(发生率>15%)为贫血(36%)和血小板减少症(21%)。接受双联治疗列队中,未发现发生率≥15%的3级或3级以上TEAE。各治疗队列间,独立委员会将4例间质性肺疾病(ILD)或非感染性肺炎事件判定为药品相关事件,包括1例1级事件、2例2级事件及1例4级事件。未观察到5级ILD事件。
在双联队列中,73.7%(n=14/19)的患者既往未接受过治疗。三联队列中,92.9%(n=13/14)的患者既往未接受过治疗。在双联和三联队列中,按PD-L1表达水平将患者分为PD-L1表达<1%(n=6,6)、1%至49%(n=6,3)和≥50%(n=7,5)。截止日期2023年03月06日的数据,两个队列的中位研究持续时间均为6个月,双联队列和三联队列中分别有31.6%和50.0%的患者仍在接受治疗。
TROPION-Lung04研究结果总结
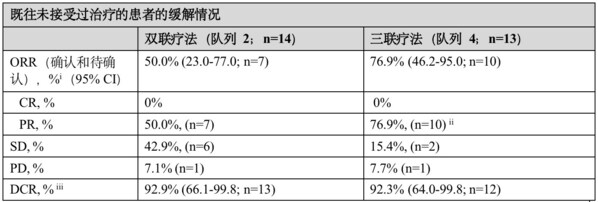
CI=置信区间;CR=完全缓解;DCR=疾病控制率;ORR=客观缓解率;PR=部分缓解;PD=疾病进展;SD=疾病稳定
i. ORR为CR+PR
ii. 队列4中的1/10例部分缓解在数据截止日期后确认。
iii. DCR为确认CR+确认PR+SD的最佳总体缓解率
Ifinatamab Deruxtecan在晚期小细胞肺癌患者的早期临床研究中表现出持久疗效
Ifinatamab deruxtecan是一种采用第一三共独有的DXd ADC技术设计的潜在first-in-class靶向B72023-H3抗体偶联药物(ADC)。
小细胞肺癌(SCLC)约占所有肺癌的15%。大约65%的SCLC肿瘤中B7-H3呈高表达,这与疾病进展和较低的生存率相关。在这项1/2期临床研究剂量递增部分,在接受ifinatamab deruxtecan(6.4~16.0 mg/kg)治疗的21例晚期SCLC患者中,确认的客观缓解率(ORR)为52.4%(95% CI:29.8~74.3)。观察到1例患者达到完全缓解(CR)和10例患者达到部分缓解(PR)。观察到的中位缓解持续时间(DOR)为5.9个月(95% CI:2.8-7.5)。截至2023年01月31日数据截止日期,中位无进展生存期(PFS)为5.6个月(95% CI:3.9~8.1),中位总生存期(OS)为12.2个月(95% CI:6.4~NA)。
在不同的B7-H3蛋白表达水平患者中观察到接受ifinatamab deruxtecan治疗导致的肿瘤缩小,未观察到临床有效性参数与B7-H3蛋白表达之间存在明显的相关性趋势。
Ifinatamab deruxtecan在SCLC患者中的安全性特征与既往该1/2期临床研究的总体人群的报告结果一致。3级或3级以上治疗中出现的不良事件(TEAE)发生率为36.4%。患者发生的最常见(>20%)TEAE为恶心(59.1%)、疲乏(50.0%)、贫血(27.3%)、呕吐(27.3%)和食欲下降(22.7%)。经独立裁定委员会确定,观察到1例与治疗相关的间质性肺疾病(ILD)-/非感染性肺炎的2级事件。有1例5级COVID-19肺炎事件,被确定为与治疗无关。
在SCLC患者亚组中,2例患者(9.1%)在基线时存在脑转移。局部晚期或转移性患者既往接受过多线治疗,既往全身治疗线数中位值为2(范围:1~7),包括含铂化疗(100%)、免疫治疗(81.8%)、紫杉烷化疗(22.7%)和伊立替康或拓扑替康化疗(22.7%)。中位随访时间为11.7个月(95% CI:4.63~12.88),2例患者仍在接受ifinatamab deruxtecan治疗。
1/2期研究SCLC亚组分析总结
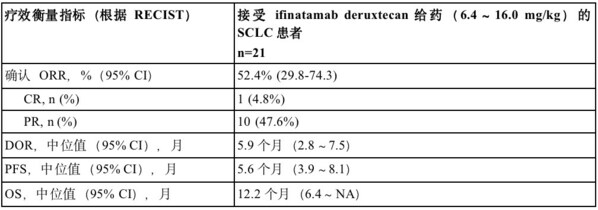
CR=完全缓解;DOR=缓解持续时间;NA=不适用;ORR=客观缓解率;OS=总生存期;PR=部分缓解;PFS=无进展生存期;RECIST=实体瘤疗效评价标准;SCLC=小细胞肺癌。
关于第一三共和阿斯利康的合作
第一三共与阿斯利康分别于2019年3月和2020年7月达成全球合作,共同开发并商业化优赫得®和datopotamab deruxtecan(Dato-DXd),在日本市场第一三共拥有各款ADC产品的独家权益。第一三共负责优赫得®和datopotamab deruxtecan的生产和供应。
关于第一三共DXd ADC产品组合
第一三共DXd ADC产品组合目前主要有六款处于临床开发阶段的ADC药物,涵盖多种癌症类型。优赫得®(HER2靶向ADC)和datopotamab deruxtecan(Dato-DXd,TROP2靶向ADC)目前正由第一三共与阿斯利康共同开发并在全球范围内商业化。另外四款第一三共DXd ADC包括patritumab deruxtecan(HER3-DXd,HER3靶向ADC)、ifinatamab deruxtecan(I-DXd;DS-7300,B7-H3靶向ADC)和raludotatug deruxtecan(R-DXd;DS-6000,CDH6靶向ADC)以及DS-3939(TA-MUC1靶向ADC)。
每款ADC均采用第一三共独有的DXd ADC技术设计,用于靶向表达特定细胞表面抗原的癌细胞,并将细胞毒性有效载荷递送至癌细胞内部。
Datopotamab deruxtecan、ifinatamab deruxtecan、patritumab deruxtecan、raludotatug deruxtecan和 DS-3939均为在研药物,尚未在任何国家/地区获批用于任何适应症。尚未完全确定安全性和疗效。
关于第一三共
第一三共是一家为社会可持续发展做贡献的创新型全球医疗保健公司,致力于发现、开发和提供新的标准疗法,以提高世界各地患者的生活质量。第一三共专注制药行业120余年,凭借其世界一流的科学和技术,为癌症、心血管疾病和其他医疗需求远未得到满足的疾病患者研发新的治疗方法和创新药物。
(新媒体责编:wa12)
声明:
1、凡本网注明“人民交通杂志”/人民交通网,所有自采新闻(含图片),如需授权转载应在授权范围内使用,并注明来源。
2、部分内容转自其他媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
3、如因作品内容、版权和其他问题需要同本网联系的,请在30日内进行。电话:010-67683008
人民交通24小时值班手机:17801261553 商务合作:010-67683008转602 E-mail:zzs@rmjtzz.com
Copyright 人民交通杂志 All Rights Reserved 版权所有 复制必究 百度统计 地址:北京市丰台区南三环东路6号A座四层
增值电信业务经营许可证号:京B2-20201704 本刊法律顾问:北京京师(兰州)律师事务所 李大伟
 京公网安备 11010602130064号 京ICP备18014261号-2 广播电视节目制作经营许可证:(京)字第16597号
京公网安备 11010602130064号 京ICP备18014261号-2 广播电视节目制作经营许可证:(京)字第16597号



